Guia 2021

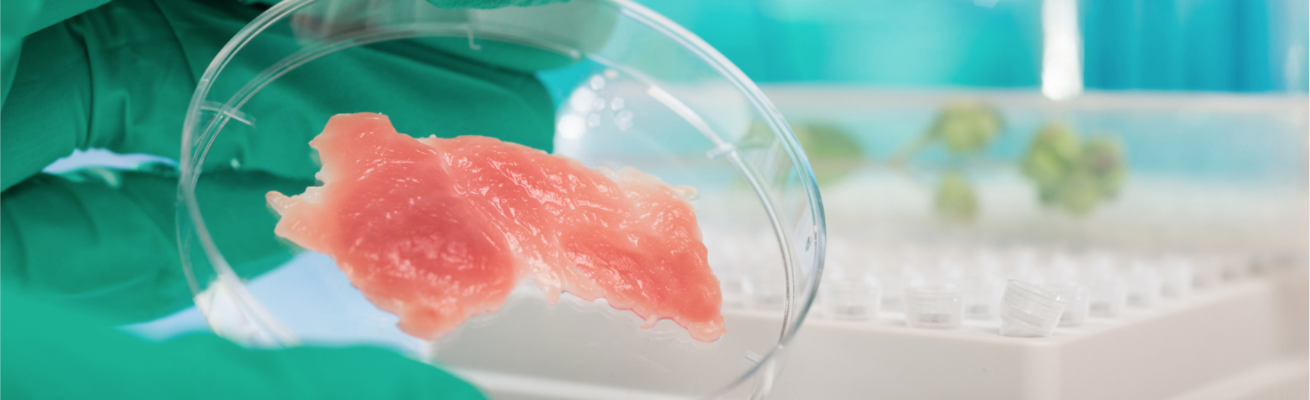
Em março deste ano, a BRF anunciou uma parceria com a startup israelense Aleph Farms para produzir carne cultivada no Brasil, com a promessa de comercializar produtos nos supermercados já em 2024. A notícia foi recebida com entusiasmo pelo setor de proteínas alternativas, mas também levantou inúmeras questões, especialmente relacionadas ao processo de produção e regulação da tecnologia de cultivo celular. Por isso, o The Good Food Institute Brasil organizou um workshop para reguladores brasileiros, com foco nas equipes do Departamento de Inspeção de Produtos de Origem Animal do Ministério da Agricultura, Pecuária e Abastecimento (DIPOA/MAPA) e da Gerência Geral de Alimentos da Agência Nacional de Vigilância Sanitária (GGALI/Anvisa).
Durante os dois primeiros dias de evento, realizados em 17 e 22 de junho, foram apresentadas informações sobre a técnica de cultivo celular para a obtenção de produtos cárneos, além de pontos de atenção que devem ser considerados no processo de regulação, com especial atenção às questões de segurança do processo e do produto final. O público, formado por 70 profissionais, teve a oportunidade de assistir às exposições da física e professora do Centro Federal de Educação Tecnológica de Minas Gerais, Dra. Aline Bruna da Silva; do biólogo e professor da UniSociesc, Dr. Bruno Bellagamba; do cientista do The Good Food Institute Estados Unidos, Dr. Elliot Swartz; e do engenheiro químico e professor da Universidade Federal de Santa Catarina, Dr. Luismar Porto.
As instalações e os desafios de escala
A fim de alinhar o conhecimento sobre a técnica e deixar todos na mesma página, o professor Luismar fez um breve resumo sobre como é o processo de cultivo celular para a obtenção da carne cultivada. “Tecnicamente, estamos falando de um produto à base de agregados de células animais produzidas em biorreatores. Fundamentalmente, o processo envolve a coleta de células, que podem vir de uma biópsia ou de uma célula embrionária. Essas linhagens celulares primárias eventualmente serão utilizadas para bancos de células, para posterior expansão ou multiplicação celular em biorreatores específicos”, explicou.
Comparando a produção convencional com a produção de carne cultivada, Luismar destacou entre os principais benefícios que podem ser alcançados com a técnica, a produtividade. “O tempo que se leva para obter carne bovina é da ordem de dois anos, com uma baixa conversão nesse processo. Uma pequena parte dos nutrientes e da energia utilizada para obter essa carne é disponibilizada no final como proteína para alimentação humana. Enquanto que, para a carne cultivada, é possível obter proteína para consumo em cerca de duas semanas”.
E os impactos apontados não se limitam a isso. Segundo o professor, há também vantagens para o meio ambiente. “Além do ganho de tempo, teremos ganhos indiretos, como a diminuição do uso de terras, não só para a criação de gado, por exemplo, mas para a plantação de alimentos para esses animais. Deixa de ser necessária a criação, o confinamento, o abate e o transporte e vai direto para o processamento, a partir dessa base biotecnológica que está muito centrada nos biorreatores”.
Apesar de soar futurista, os biorreatores são equipamentos amplamente utilizados na indústria de bebidas e alimentos. Por exemplo, para a produção de cerveja e produtos lácteos. No entanto, os biorreatores teciduais são diferentes dos utilizados para fermentação, pois normalmente precisam atender à necessidade de que as células animais, sobretudo quando cultivadas de forma isolada, são muito sensíveis aos esquemas de agitação e mistura. “Temos biorreatores de parede rotativa, de movimento ondulatório, de cultura celular e bioimpressora. No entanto, são biorreatores comerciais, o desafio é criar um biorreator de escala industrial”.
Como resultado final desse processo industrial, espera-se obter um produto que mimetize a experiência sensorial da carne convencional em aparência, textura e sabor. No entanto, para o professor Luismar, a tecnologia de cultivo celular pode ir além. “Eu quero crer que, no futuro, não haverá um comprometimento da indústria em apenas mimetizar a carne convencional. Eu gosto da analogia de que “sorvete não dá em árvore”, e, no entanto, as pessoas preferem comer o sorvete do que os seus componentes naturais. Então, é muito possível que essa tecnologia gere um conjunto de novas estruturas à base de proteínas animais, e que não necessariamente mimetizam a carne obtida pelo processo convencional.”.
No entanto, para que tudo isso aconteça no Brasil, ao ponto de colocar o país no mapa da tecnologia de cultivo celular, é preciso acelerar as inovações e as pesquisas neste campo. “Atualmente, as iniciativas estão mais concentradas nos Estados Unidos, Europa, Israel, alguns países da Ásia, como Cingapura e China, além da Austrália. O maior gap está na África e na América Latina, com poucas iniciativas em andamento. Estamos, aparentemente, perdendo o compasso”, conclui o professor.
Da biópsia ao biorreator
Seguindo com as exposições, o professor Bruno Bellagamba enfatizou a importância do evento. “Poder discutir todos esses assuntos do ponto de vista regulatório, com as agências reguladoras, é um momento histórico para o país.”. Em sua fala, Bellagamba apresentou aspectos relevantes sobre as primeiras etapas do processo de cultivo celular. A partir de dados do grupo de estudos do professor Mark Post, conhecido por produzir o primeiro hambúrguer cultivado em 2013, o pesquisador apresentou as duas formas de fazer a biópsia para retirada de células do animal: por agulha ou por incisão.
De acordo com o professor, a biópsia por agulha gera pouco ou nenhum desconforto ao animal e exige pouca sedação e analgesia. No entanto, obtém-se pouca quantidade de amostra de células, cerca de 0,5g, exigindo várias amostragens. Já a incisão, processo para obter músculo e tecido adiposo, garante maior quantidade de tecido, cerca de 10g a 15g, resultando em apenas uma amostragem por animal. Contudo, gera maior desconforto e exige maior dose de analgésicos e sedativos. “Portanto, também há uma questão de bem-estar animal para escolher entre um método e outro”, afirma.
Além disso, há, ainda, a questão do risco de contaminação que pode sofrer o material biológico coletado. No procedimento de coleta por agulha o potencial de contaminação é baixo porque a incisão é bem menor. Já na incisão com bisturi, seria necessário um cuidado maior com a assepsia do local onde o material será coletado para evitar contaminação com microorganismos que podem ser propagados na cultura celular posteriormente. “Do ponto de vista regulatório seria importante observar questões relacionadas ao manejo do animal, antes e após as biópsias; limitar o número de procedimentos para evitar sofrimento animal desnecessário; intervalo mínimo entre os procedimentos; quantidade máxima de tecido coletado por biópsia para se ter um bom início de cultivo, sem comprometer a saúde do animal; e o armazenamento e transporte da amostra para processamento posterior.”, apontou Bellagamba.
Com relação à escolha do animal doador, também há pontos para serem considerados. “Seria um indivíduo macho, pois apresentam mais receptores androgênicos, o que garante maior proliferação celular; com alguns meses de idade, uma vez que apresentam mais células satélites; mantido em manejo extensivo, sem confinamento, para gerar menor estresse, com alimentação a base de forragem, capazes de gerar mais fibras do tipo I, que garantem contração rápida e mais células satélites. A biópsia deveria, ainda, ser feita na parte dianteira, na região do pescoço até as costelas.”, indicou.
Depois que o material é coletado, precisa ser levado para um laboratório de cultivo celular para que as células sejam isoladas e multiplicadas. Cada tipo de célula precisa de um meio de cultivo com algumas diferenças, mas que sejam ricos em nutrientes e fatores de crescimento para que continuem se proliferando e permanecendo multipotentes. Segundo o professor, o processo é simples, mas precisa ser feito com cuidados de assepsia rigorosos para evitar contaminação por microorganismos. “Com relação ao cultivo em larga escala, do ponto de vista da qualidade do processo, idealmente, a cada passagem de processo, seria necessário um protocolo de qualidade específico, atentando-se a: viabilidade celular, controle microbiológico, estabilidade genética e certificação de que não estão sendo produzidos metabólitos tóxicos que podem ser prejudiciais às amostras e à saúde humana”.
Contribuindo com a apresentação do professor Bruno e respondendo a questões trazidas pelo MAPA, o professor Luismar chamou a atenção para a sustentabilidade desse processo e à garantia do bem-estar animal. Segundo ele, uma célula embrionária é capaz de gerar milhares de toneladas de carne. “Em princípio, é possível fazer um banco de células primárias e um outro banco de células secundárias, com possibilidade de ampliá-los ainda mais. A partir delas, podem ser geradas milhares de toneladas de carne em instalações industriais, de forma que, em tese, uma única célula-tronco pode ser utilizada por dez anos em uma produção de larga escala. Ou seja, não vai ser necessário fazer biópsias com frequência.
Com relação aos meios nutritivos, Luismar ponderou que já há alternativas ao soro fetal bovino, utilizados nas primeiras experiências com carne cultivada. “As propostas de comercialização de meio nutritivo, partem do princípio de que não serão utilizados soro fetal bovino, pois esse seria um contraponto muito forte em relação aos direitos dos animais. Também há claims que já apontam para um domínio tecnológico e patentes, de que não serão utilizados antibióticos em nenhuma parte do processo. É claro que isso é um grande desafio, que precisa ser provado em larga escala, mas as propostas que estão surgindo vão nessa direção. Por isso, do ponto de vista regulatório, será necessário criar mecanismos de controle das matérias-primas nas entradas desses biorreatores com relação à purificação e à ausência de vírus, bactérias e fungos, assim como uma inspeção detalhada na saída.”.
Do biorreator ao bife
Contribuindo com informações referentes à próxima etapa do cultivo celular, a professora Aline destacou o principal objetivo da técnica, que é mimetizar a carne de origem animal com perfeição. Segundo ela, a engenharia de tecidos tem como meta o corte de carne do tipo prime, caracterizado por conteúdo magro e gordo (células de músculo e de gordura). “O resultado final para o consumidor deve ser de palatabilidade, garantindo aparência, suculência, maciez e sabor. Isso vai depender de como essas células de músculo e gordura estarão distribuídas para formar esse tecido tridimensional. Por isso, precisamos entender a estrutura da carne (músculo esquelético), que tem uma composição aproximada de 90% de fibras musculares, 10% de tecidos conjuntivos e gordurosos e 0,3% de sangue.”.
Isso leva a uma etapa fundamental do processo, que é a maturação das células, logo após a sua expansão em um biorreator. “A maturação também pode ser feita em um biorreator, por meio de uma estrutura tridimensional que vai mimetizar a matriz extracelular natural, chamada de scaffold, gerando posteriormente pedaços inteiros como um bife. Também pode ser utilizado materiais bidimensionais para gerar um agregado de células, que depois podem ser estruturadas em carnes processadas, como uma carne moída, por exemplo.”.
Vale destacar que essa matriz extracelular (scaffold), que nada mais é do que a parte acelular de qualquer tecido ou órgão, tem a função de dar suporte mecânico para as células, com pontos de adesão, para que as células possam aderir, e, depois, na fase de maturação, se diferenciar no tipo celular adequado. Além disso, precisa ter características físico-químicas e mecânicas similares às células, bem como porosidade para que as células possam crescer, se expandir e formar uma estrutura tridimensional. “Um dos pilares da engenharia de tecidos é desenvolver de forma sintética essa matriz extracelular, que pode ser diferente para cada tipo de tecido que se pretende produzir. Existem muitas formas para se fazer um scaffold, como a partir de nanofibras poliméricas biodegradáveis, por exemplo”.
Além dessas características, Aline também defende que os scaffolds sejam de origem vegetal, comestíveis, baratos, com processamento escalável, e com resistência mecânica compatível com as tensões geradas no interior do biorreator. Outras possibilidades de materiais para produção de scaffolds são: alginato, gelatina, quitosana, proteína de soja, celulose, micélios fúngicos (quitina, celulose, proteínas), frutas ou vegetais descelularizados, etc.
Outro ponto importante a se destacar é a vascularização da carne cultivada, uma vez que os tecidos musculares são ricos em redes microvasculares. No entanto, do ponto de vista técnico, segundo Aline, os vasos sanguíneos podem não ser um componente essencial do sabor ou da textura da carne. “Por isso, o que tem se pensado é substituir a rede de vasos por biorreatores de perfusão, que podem fazer o papel das redes microvasculares”.
Finalizando a sua apresentação, a professora citou alguns lançamentos do mercado internacional, chamando a atenção para as carnes híbridas. “Os primeiros lançamentos não são 100% carne cultivada. A carne de frango da EatJust, já regulamentada em Cingapura, tem 70% de frango cultivado e 30% de base vegetal. Também temos a Super Meat, empresa israelense que fabrica produtos plant-based, que propõe adicionar até 30% de células cultivadas ao produto vegetal. Isso deve conferir sabor e conteúdo nutricional. A Higher Steaks, startup britânica que produziu um protótipo de bacon, utiliza 50% de células musculares e 50% de scaffold à base de plantas, proteínas e gorduras vegetais. Com relação à bioimpressão, a KFC firmou uma parceria com a empresa russa Bioprinting Solutions, para desenvolver empanados de frango com tecnologia de bioimpressão, utilizando células de frango e material vegetal. Já a Aleph Farms anunciou que produziu um bife por bioimpressão em fevereiro deste ano.”.
Segurança de alimentos e considerações sobre o impacto ao meio ambiente
Dr. Elliot começou sua fala apresentando a linha do tempo da carne cultivada, que teve início em 2013, com o primeiro hambúrguer cultivado, desenvolvido pelo já mencionado professor Mark Post, na Holanda. De lá pra cá, já são mais de 100 empresas ao redor do mundo atuando com a tecnologia, com investimentos avaliados em aproximadamente USD $225 milhões apenas em 2020, além da primeira experiência de regulamentação ocorrida em Cingapura. Com relação às perspectivas de futuro, o Dr. Elliot aponta para um movimento crescente de processos regulatórios em todo o planeta, e avanços que possibilitem preços competitivos para a carne cultivada. E, segundo a consultoria McKinsey, até 2030, a produção estimada de carne cultivada poderá medir entre 0,4 a 2,1 milhões de toneladas métricas. Isso significa 0,1 a 0,56% da demanda global de carne (375 milhões de toneladas métricas).
Falando sobre os impactos ambientais da produção da carne cultivada, o Dr. Elliot prevê que a tecnologia provavelmente terá uma pegada ambiental menor em comparação com a produção de carne convencional. “Se energias renováveis forem usadas, a pegada de carbono cai em 80%, em relação à produção convencional”, afirmou. A projeção foi feita com base em um estudo encomendado pelo GFI e pela organização Gaia, chamado de LCA (avaliação do ciclo de vida). Com base em dados fornecidos por 15 empresas da cadeia de abastecimento de carne cultivada, foi criado um modelo de como a carne cultivada pode ser produzida até o ano de 2030, avaliando os impactos ambientais de uma instalação em escala comercial que produz 10.000 toneladas métricas de um produto de carne cultivada por ano. Para nutrir as células, seria utilizado um meio livre de antibióticos e soro, incluindo apenas aminoácidos derivados principalmente de hidrolizado de soja e suplementadas com aminoácidos de fermentação e síntese química; glicose de milho; proteínas recombinantes e fatores de crescimento produzidos por fermentação.
Seguindo o modelo, os impactos do aquecimento global seriam diminuídos em 17%, 52% e 85% a 92% em comparação à produção convencional de frango, porco e boi, respectivamente. Também foi possível comprovar que a carne cultivada é 3,5 vezes mais eficiente do que o frango convencional, que é a mais eficiente dentre as carnes convencionais, na conversão de ração em carne. Por isso, a produção de carne cultivada reduziria o uso da terra em 63% a 95% em comparação com a carne convencional. Por fim, foi possível concluir que a carne cultivada também deve ser menos poluente à água, com redução de 29% a 93% em comparação com todas as formas de carne convencional, e usar significativamente menos água azul, encontrada em reservatórios de água superficial e subterrânea, com redução de 51% a 78% em relação à produção convencional de carne bovina (quase o mesmo que frango e porco).
Na segunda parte de sua apresentação, o Dr. Elliot falou sobre a segurança do processo. “De que forma o processo de produção de carne cultivada pode representar novas ameaças à segurança de alimentos para consumidores e como podemos mitigar esse risco?”. Para isso, indicou para cada etapa da produção – seleção da linhagem celular, proliferação, diferenciação e maturação, separação das células de interesse e formulação do produto final, fabricação e embalagem – algumas possibilidades para garantir que o alimento seja seguro. “No entanto, destaco que não são recomendações ou ações regulamentares formais, uma vez que alguns detalhes são hipotéticos ou estão sujeitos a alterações.”.
As orientações envolvem selecionar animais saudáveis para coleta de células, verificar se as células estão livres de agentes adventícios, prevenir a contaminação cruzada, não utilizar produtos de origem animal como meio nutritivo, limpar e esterilizar os biorreatores, utilizar materiais seguros, sem origem animal, comestíveis ou biodegradáveis para produzir os scaffolds, realizar testes para detectar a presença de alergênicos e resíduos, evitar erros durante o processo de embalagem que que possam introduzir micróbios patogênicos no produto, apresentar tabela nutricional detalhada, e realizar procedimentos de manuseio e cozimento semelhantes ao da carne convencional.
O Dr. Elliot trouxe, ainda, pontos de atenção fundamentais para acelerar o desenvolvimento da indústria de carne cultivada, e que tem relação direta com os processos regulatórios. “A falta de orientação aberta está retardando os fabricantes de carne cultivada de várias maneiras, incluindo o projeto das instalações, as especificações dos equipamentos e a compreensão dos dados necessários para coletar e enviar, além de atrasar os fornecedores de carne cultivada, incluindo fornecedores de insumos para meios de cultura de células, materiais de suporte, auxiliares de processamento e equipamentos. Um desafio contínuo será desenvolver estruturas em diferentes regiões que garantam a segurança do consumidor, sem sobrecarregar significativamente os fabricantes ou diferir umas das outras.”, afirmou.
Analisando o cenário regulatório internacional, o Dr. Elliot acredita que, depois de Cingapura, o Canadá, os Estados Unidos, a União Europeia, a Austrália e a Nova Zelândia devem ser os próximos a aprovar a regulação da carne cultivada. Enquanto isso, Japão e Israel seguem desenvolvendo a estrutura de seus documentos regulatórios. Já o Brasil, a Índia e a China estão monitorando os movimentos globalmente para definirem que estratégias vão desempenhar.
Próximos passos
O workshop segue até o início de julho, com atividades fechadas para a ANVISA e o MAPA, entre os dias 29 e 30 de junho e 1 de julho. Neste período, o grupo irá conhecer e trocar experiências sobre processos regulatórios em carne cultivada com representantes dos Estados Unidos, Europa e Singapura.